هر ساله چندین داروی جدید در دنیا مجوز میگیرند که قبل از تولید هرکدام هزاران ترکیب کاندید کنارگذاشته شدهاند. سفر تحقیق و توسعه برای داروهای جدیدی که به بازار عرضه میشوند ۱۰ تا ۱۵ سال طول میکشد و به طور میانگین ۱.۱۵ میلیارد پوند هزینه دارد.
همانطور که در شکل زیر میبینید، پروسهی تولید یک دارو از چهار گام کلی تشکیل شدهاست که در ادامه شما را با جزئیات هر کدام آشنا خواهیم کرد.
|
در این مقاله میخوانیم:
|
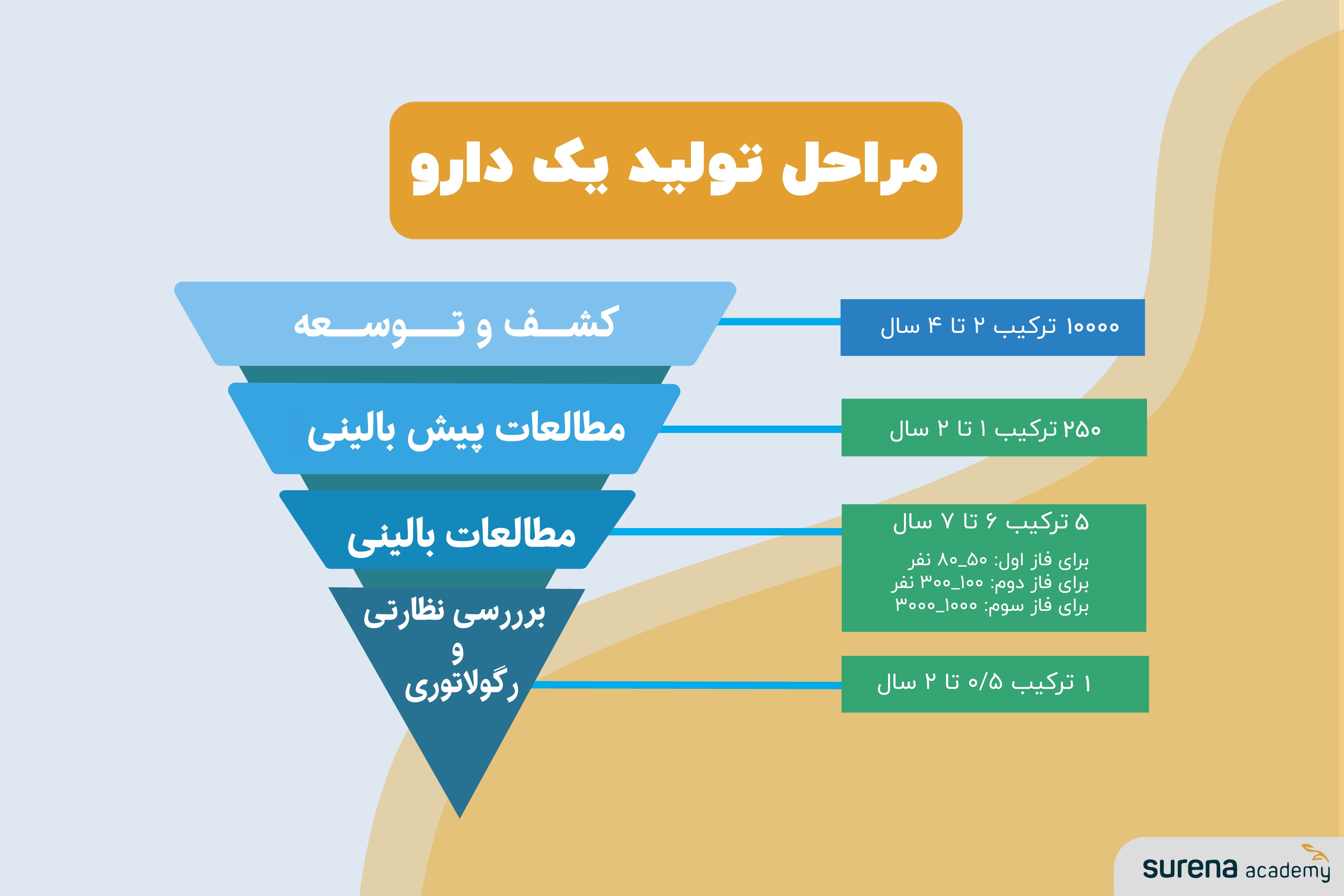
کشف و توسعه، تحقیقات برای داروی جدید در آزمایشگاه آغاز میشود.
کشف
به طور معمول،روشهای کشف یک ترکیب جدید دارویی توسط محققان عبارتند از:
👈بررسی روند بیماری و مهندسی معکوس برای طراحی محصولی که اثرات بیماری را متوقف یا معکوس کند.
👈آزمایش روی ترکیبات مولکولی برای یافتن اثرات مفید احتمالی در برابر تعداد زیادی از بیماریها.
👈درمانهای موجود که اثرات پیشبینی نشدهای دارند و میتوان برای بیماریهای دیگری از آنها استفاده کرد.
👈فناوریهای جدید مانند دارورسانیهای نوین.
در این مرحله از فرآیند تولید دارو، هزاران ترکیب شانس این را دارند که بعنوان درمان دارویی جدید به مرحله توسعه برسند. با این وجود، پس از آزمایشهای اولیه، تنها تعداد کمی ازاین ترکیبات امیدبخش به نظر میرسند و نیاز به مطالعه بیشتر خواهند داشت.
توسعه
هنگامی که محققان یک ترکیب امیدبخش برای توسعه را شناسایی کردند، آزمایشاتی را برای جمعآوری اطلاعات راجع به موارد زیر انجام میدهند:
👈چگونگی جذب، توزیع، متابولیز و دفع دارو
👈مزایای بالقوه و مکانیسمهای عملکرد آن
👈بهترین دوز
👈بهترین روش تجویز دارو (مانند خوراکی، تزریقی و...)
👈عوارض جانبی یا سمیت دارو
👈چگونگی تاثیر در گروهها و افراد مختلف (مانند جنسیت، نژاد یا قومیت)
👈ارتباط و تداخل آن با سایر داروها
👈اثربخشی آن در مقایسه با داروهای مشابه
مطالعات پیش بالینی، داروها برای پاسخ به سوالات ابتدایی درمورد ایمنی، آزمایش میشوند.
محققان قبل از آزمایش داروها در افراد، باید با استفاده از مطالعات پیشبالینی مطمئن شوند كه این دارو پتانسیل ایجاد صدمات جدی و ایجاد سمیت نداشته باشد. دو نوع تحقیقات پیشبالینی عبارتند از مطالعات:
👈In Vitro
👈In Vivo
FDA محققان را برای مطالعات آزمایشگاهی پیشبالینی به استفاده از "عملیات خوب آزمایشگاهی" یا GLP که در آییننامهی توسعه محصول پزشکی تعریف شده، ملزم میکند.
این آیین نامه حداقل الزامات اساسی را برای تحقیقات در بخشهای زیر در نظر گرفته است:
👈هدایت مطالعه
👈پرسنل
👈امکانات
👈تجهیزات
👈پروتکلهای کتبی
👈روشهای عملیاتی
👈گزارش کار
👈سیستم نظارت بر تضمین کیفیت برای هر مطالعه (برای اطمینان از ایمنی محصول)
معمولاً مطالعات پیشبالینی چندان وسیع نیستند. با این حال، این مطالعات باید اطلاعات دقیقی در مورد دوزینگ و میزان سمیت ارائه دهند. محققان پس از آزمایشهای پیشبالینی، یافتههای خود را مرور کرده و تصمیم میگیرند که آیا این دارو باید روی افراد آزمایش شود یا خیر.
مطالعات بالینی، داروها روی افراد آزمایش میشوند تا ایمنی و اثربخشی آنها کنترل شود.
در حالی که تحقیقات پیشبالینی به سؤالات اساسی در مورد ایمنی دارو پاسخ میدهد، این مطالعات نمیتوانند جایگزینی برای مطالعه روی نحوهی تعامل دارو با بدن انسان باشد.
"تحقیقات بالینی" به مطالعات یا کارآزماییهایی گفته میشود که روی افراد انجام میشود. از آنجا که محققان مطالعهی بالینی را طراحی میكنند، آنها از قبل برای هر یك از مراحل مختلف تحقیقات بالینی، روندی که میخواهند انجام دهند را درنظر گرفته و برنامهریزی میکنند.
آزمایشات بالینی برای پاسخ به سؤالات تحقیقاتی مربوط به یک داروی جدید، طراحی میشوند. کارآزماییها باید از یک پروتکل تحقیقاتی پیروی کنند که شامل جزئیات اهداف اصلی مطالعه، طراحی مطالعه و ملاحظات آماری میباشد.
سپس درمورد جزئیاتی مانند موارد زیر تصمیم میگیرند:
👈چه کسی واجد شرایط شرکت در کارآزمایی میباشد؟
👈چند نفر بخشی از مطالعه خواهند بود؟
👈مطالعه برای چه مدت ادامه خواهد داشت؟
👈آیا گروه کنترل و یا راههای دیگری برای جلوگیری از خطا وجود دارد؟
👈دارو چگونه و با چه دوزی به بیماران تجویز و با چه دوزی تزریق میشود؟
👈نحوهی بررسی و تجزیه و تحلیل دادهها
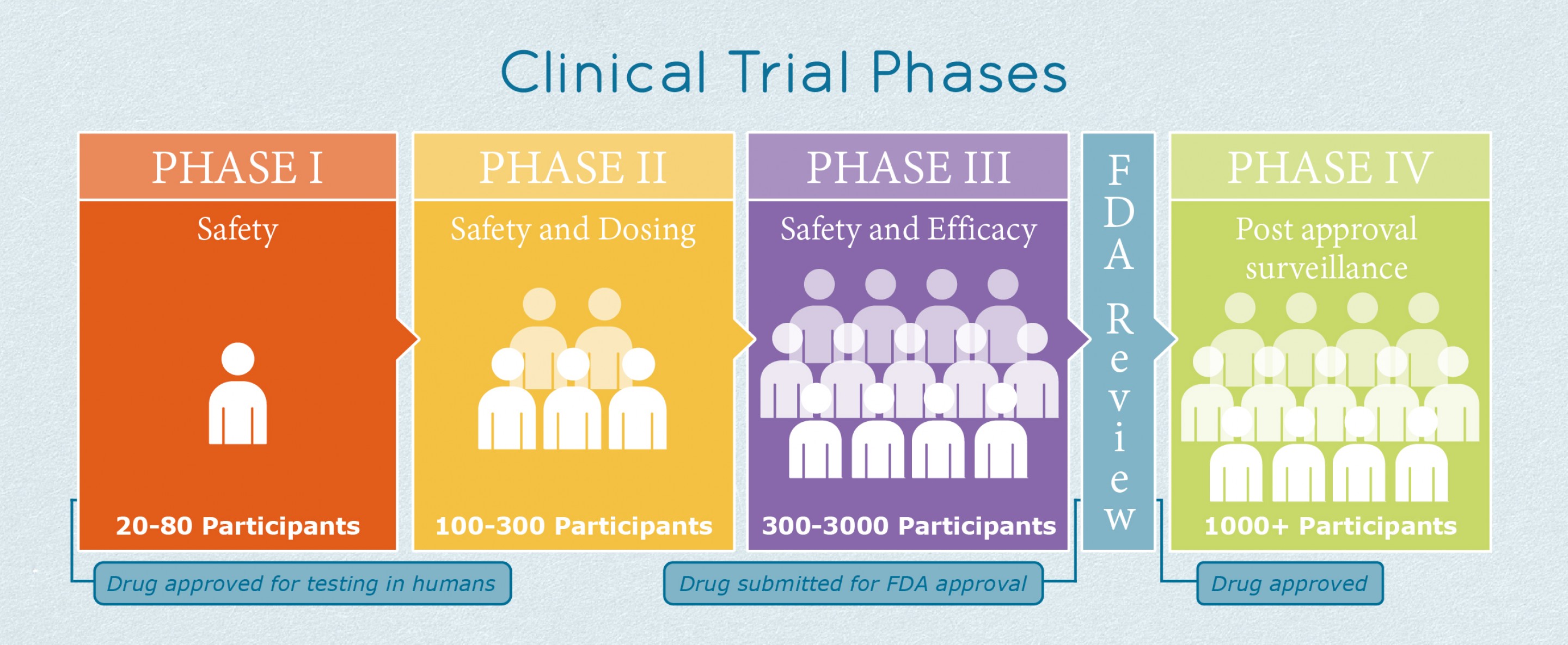
مرحله بالینی تولید دارو از یک سری "فازها" پیروی میکند.
چگونه یک دارو در مطالعات بالینی تأیید میشود؟
مرحله اول:
تعداد شرکتکنندگان: ۲۰ تا ۱۰۰ نفر. که این افراد یا سالم هستند یا به بیماریای که برای درمان آن درحال ساخت دارو هستید مبتلا هستند.
طول مطالعه: به طور معمول چند ماه
هدف اصلی: تعیین ایمنی در افراد و جمعآوری اطلاعات در مورد دوز مناسب. در مطالعات مرحله اول همچنین بهترین نحوهی استفاده از دارو برای محدود کردن سمیت و تقویت اثر درمانی نیز بررسی میشوند.
مرحله دوم:
تعداد شرکت کنندگان: چند صد نفر. مشارکتکنندگان به بیماریای که برای درمان آن درحال ساخت دارو هستید مبتلا هستند.
طول مطالعه: از چند ماه تا دو سال.
هدف اصلی: برای به دست آوردن اطلاعات ایمنی بیشتر و همچنین برای تعیین اثربخشی و عوارض جانبی.
مرحله سوم:
تعداد شرکت کنندگان: ۳۰۰ تا۳۰۰۰ نفر. شرکت کنندگان به بیماریای که برای آن درحال ساخت دارو هستید مبتلا هستند.
طول مطالعه: از یک تا چهار سال
هدف اصلی: تعیین اثربخشی دارو و نظارت بر عوارض جانبی. به دلیل افزایش تعداد شرکت کنندگان در این مرحله ، معمولاً عوارض جانبی طولانی مدت یا نادر که ممکن است در مراحل قبلی دیده نشده باشند، کشف میشوند. بیشترین میزان اطلاعات درمورد ایمنی در مرحله سوم جمع آوری میشود.
بررسی نظارتی و رگولاتوری، تصویب و نظارت ایمنی پس از بازاریابی
برنامه داروی جدید
روند درخواست مجوز بازاریابی در ایالات متحده به عنوان New Drug Application (NDA) شناخته شده است. در اتحادیه اروپا و سایر کشورها در سراسر جهان، به همین فرآیند برنامهی اجازهی بازاریابی یا Marketing Authorisation Application (MAA) گفته میشود.
مقامات نظارتی مسئولیت ارزیابی علمی NDA یا MAA را بر عهده دارند که تلاش میکنند تشخیص دهند آیا:
👈این دارو به عنوان درمانی برای بیماریای که برای آن ایجاد شده ایمن و مؤثر است؟
👈مزایای درمانی این دارو از خطرات آن بالاتر است؟
👈برچسب دارو برای هدف مورد نظر مناسب است؟
👈روشهای استفاده شده برای تولید دارو و اقدامات لازم برای اطمینان از کیفیت دارو رضایتبخش است؟
در نهایت باتوجه به مراحل ذکر شده واضح است که این فرآیند بسیار طولانی و هزینهبر است و تنها دلیل این موضوع، حساسیت بالای محصولات دارویی است چراکه با جان انسانها سر و کار دارد. ایمنی و اثرگذاری هر ترکیب پیش از اینکه توسط بیماران استفاده شود باید طی آزمایشات فراوان ثابت شده و از خطرات احتمالی جلوگیری شود.
|
این مقالات برایتان جذاب است: |



راسته که برای تولید یک داروی جدید به 1 میلیارد دلار پول نیاز هست؟ اگه میشه به طور کامل تری در رابطه با هزینه دارو مطلب بذارین.